樊建辉,侯建光,郭福祥,张俊峰,牛姣
(河南仰韶酒业有限公司研究中心,河南省渑池县472400)
摘要:通过对仰韶超高温大曲在发酵过程中微生物动态变化的初步试验、分析,结果表明,酵母菌,霉菌和细菌
的数量均呈先上升后下降又上升的趋势,并且加入5%超高温细菌曲的试样其细菌数量较加入3%的细菌数量明
显增多,其顶火温度较普通高温曲高出2℃。
关键词:超高温大曲;取样点;微生物;动态变化
中图分类号:TS262.3;TS261.1;TS201.2 文献标识码:B
中国白酒的发酵过程实际上是各类微生物的生长代谢过程,不同地域、气候、环境条件及生产工艺,形成了不同的微生物群系及不同的微生物代谢变化规律,从而造就了不同的白酒风格[1]。大曲发酵主要是环境微生物在大曲中富集、生长并产生酶及代谢产物的过程。在白酒酿造的过程中,酒曲作为酿造的主要动力,直接影响着酒体的最终品质。河南仰韶酒业由于其特殊的地理环境,其高温曲制曲温度可高达70℃,这一超高温也成为其他白酒产区无法复制的特点,同时也是仰韶兼香型白酒独特风格所在。
本实验通过加入本厂自己培养的代谢吡嗪类物质的超高温细菌曲,通过研究其发酵过程中的微生物动态变化,为后续研究这些代谢物质对酒质的影响起着重要支撑作用,也为进一步调控制曲工艺有着重要指导意义
1 材料与方法
1.1 材料
1.1.1 样品及处理
高温大曲,超高温细菌麸曲均取自本公司。将超高温细菌麸曲分别以3%、5%的比例加入到曲坯中,选取7 个取样点。
取样点的确定:
根据生产经验结合大曲生产工艺的生产特点确定大曲生产过程中可能对大曲质量产生影响的重要阶段的关键点作为取样点。
结合实际生产经验和大曲生产的工艺特点选取大曲发酵过程中的7 个关键点作为优化点,取样方法为:
优化取样点1:取小麦混合粉碎后加水拌和前的原料,从暂贮仓分别取5 个不同位置,混匀,备用;优化取样点2:取卧曲前压制好的曲块,随机选取3块,将大曲按对角平分2 块,取其中1 块粉碎混匀,备用;
优化取样点3:晾霉结束(第4 天)时,在曲房不同位置随机挑取3 块有代表性大曲,将大曲按对角平分成2块,取其中1块粉碎混匀,备用;
优化取样点4:取达到顶火温度(第10 天)时大曲,在曲房不同位置随机挑取3 块有代表性大曲,将大曲按对角分成2 块,取其中1 块粉碎混匀,备用。
优化取样点5:取大火结束时(第18 天)大曲,在曲房不同位置随机挑取3 块有代表性大曲,将大曲按对角分成2 块,取其中1块粉碎混匀,备用;优化取样点6:取后火结束时(第35 天)大曲,在曲房不同位置随机挑取3 块有代表性大曲,将大曲按对角平分成2块,取其中1块粉碎混匀,备用;
优化取样点7:出房验收(第45 天)时,随机选取经品评合格的大曲3 块,将大曲按对角平分成2块,取其中1块粉碎混匀,备用;
样品粉碎及保存方法:要求过0.3mm 筛孔,封装于密封袋中,置于-20℃保存1~3 个月或-4℃保存7d,备用。
1.1.2 培养基
细菌计数培养基:牛肉膏蛋白胨培养基[2]。酵母计数培养基:豆芽汁培养基。
霉菌计数培养基:市售孟加拉红培养基。
1.1.3 主要仪器设备
电子天平(YP 10002,上海越平科学仪器有限公司),超净工作台,立式压力蒸汽灭菌锅(YXQ-LS-50S11,上海博讯实业有限公司医疗设备厂),隔水式恒温培养箱(PYX-DHS-50×65,上海跃进医疗器械厂)
1.2 方法
1.2.1 菌落的分离
将大曲在无菌条件下粉碎,取10g 置于装有90mL 无菌水带玻璃珠的三角瓶中,置于120r/min摇床中,使其中的玻璃珠混匀大曲粉,30min 后取出,用移液枪吸取1mL 菌悬液于装有9mL 无菌水的试管中,进行系列稀释,酵母菌和霉菌取10-2、10-3、l0-4 和10-5 进行平板涂布,细菌取10-3、10-4、10-5和10-6 进行平板涂布[3]。
1.2.2 微生物培养及计数
细菌:35~37℃倒置培养1~2d,进行细菌平板计数
酵母菌和霉菌:28℃倒置培养2~3d,进行平板计数。
1.2.2.1 计数方法
采用平板菌落计数法。将待测样品经适当稀释之后,使其中的微生物充分分散成单个细胞,取一定量的稀释样液接种到平板上,培养一定时间后,由每个单细胞生长繁殖而形成肉眼可见的菌落,即一个单菌落应代表原样品中的一个单细胞。培养一段时间后,取出培养平板,算出同一稀释度上菌落平均数。
一般选择CFU(Colony-FormingUnits),菌落形成单位)在20~300 之间的平板进行计数。在这个范围之外则不能正确地指示样品中微生物的真实数量。
当所有平板的CFU 都低于20 个时,记录稀释倍数最小平板的菌落数。
当所有稀释倍数平板的CFU都大于300 个/cm2(但小于100 个/cm2)时,以CFU 最接近于300 个的平板作为计数标准,其CFU 值乘以其相应的稀释倍数即为样品含菌数的估计值。
2 结果与分析
2.1 酵母的变化
对加入不同比例超高温细菌曲的大曲发酵过程中不同取样点的酵母菌进行分离,其数量见图1。
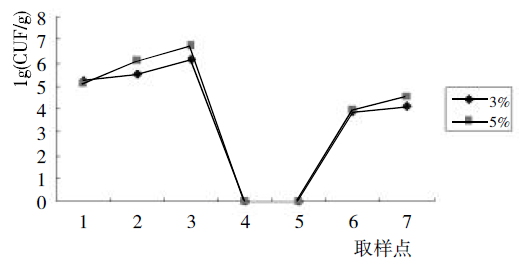
图1 制曲过程中酵母菌数量的动态变化
由图1 可以看出,不管是加入3%还是5%超高温细菌曲培养出来的高温酒曲,其发酵过程中酵母菌的数量变化均呈先上升后下降又缓慢回升的趋势,在优化点1,酵母菌的数量就已经在105CFU/g,这是由于环境中及原料本身有大量的微生物存在,伴随着曲块压制成形入房再到晾霉结束,随着温度的缓慢上升,加上氧气充足,淀粉水解释放出一部分水份,适宜的生长条件使得酵母菌开始大量繁殖,在优化点3数量达到最大。优化点3 以后,曲温上升,受温度和繁殖方式的影响,酵母菌全部死亡,故分离不出酵母菌。而在后火结束时,由于品温回落,这为一些喜低温的酵母提供了良好的契机,所以此时酵母的数量又开始回升。
2.2 霉菌的变化

图2 制曲过程中霉菌数量的动态变化
由图2 可以看出,霉菌的数量呈先上升后下降又上升的趋势,在优化点1,霉菌的数量与细菌,酵母菌相比较少。由于霉菌对水分的要求较低,故发酵开始后,其数量急剧上升,并以根霉的生长占绝对优势,同酵母菌一样,在晾霉结束时其数量达到顶峰,优化点3 以后,随着品温的上升,水分蒸发快,酒曲中养分的消耗,酸度增大,这些恶劣的环境使得大部分霉菌死亡,但仍有一些耐高温的霉菌存在,培养中可以观察到这个阶段主要以毛霉为主。
后火结束时,由于品温下降,此时需水量少的霉菌呈现“夕阳无限好”的局面,所以在取样点5 以后,霉菌数量又出现回升趋势。
加入3%细菌曲的样,酵母菌与霉菌的数量均比加入5%细菌曲的样低一点,但仍处于一个数量级,这可能与不同批次实验的环境差异有关。
2.3 细菌的数量变化
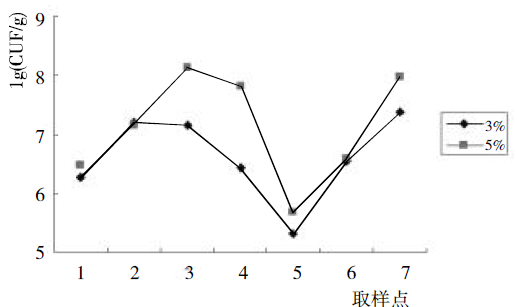
图3 制曲过程中细菌数量的动态变化
由图3 可以看出,细菌在大曲发酵过程中的变化呈先上升后下降又上升的趋势,并且总体数量比酵母菌和霉菌偏高。由于加入了超高温细菌曲,并且在抽样时检测到,大火顶起时顶火温度可高达70℃。曲块在入房前,来自于水、空气、原料、机械设备中就存在大量的细菌,在106CFU/g,曲块入房后,由于适宜的生长条件,细菌数量急剧上升(优化点2和优化点3),在合房结束时达到最大,随着温度的升高,环境中的一些不耐高温的细菌逐渐死亡,细菌数量也开始下降,但仍处于一定的水平,因为此时加入的这部分耐高温细菌曲以及环境中的其它一些耐高温细菌占了绝对优势,后火结束时,由于温度的回落,使得适宜此条件的一部分细菌又开始生长,所以细菌数量又出现了回升的趋势。
图3 中也可以看到,加入不同比例的超高温细菌曲,曲块发酵过程中细菌数量也不同,5%的细菌数量明显比3%的高。
3 结论
3.1 加入3%细菌曲的样,酵母菌与霉菌的数量均比加入5%细菌曲的样低一点,但仍处于一个数量级,这可能与不同批次实验的环境差异有关。
3.2 将不同优化点的样品进行稀释平板分离,计数,酵母菌与霉菌的数量均呈先上升后下降然后缓慢回升的趋势,其中高温情况下酵母菌未检出,霉菌此阶段以毛霉为主。细菌的数量变化也呈先上升后下降又回升的趋势,并且加入5%超高温细菌曲的数量明显高于3%的数量。
3.3 高温酒曲是酱香的来源,而酱香味物质形成的前驱物质就是各种氨基酸。它需要各种微生物尤其是耐高温芽孢杆菌以及代谢的酶类的共同作用。故本实验试图加入部分超高温细菌曲以增强酱香,但其对酒质的影响仍需进一步研究。
3.4 加入外援菌种的仰韶超高温大曲顶火温度高(70~72℃)、持续时间长,造成了其酒质不可复制的特点,为后续科研试验与风格形成打下坚实基础。
[参考文献]
[1]胡建祥,杨涛,蔡关林等.凤兼复合型太白酒微生物区系研究_ 大曲微生物区系[J].酿酒科技,2012(5)
[2]沈萍,陈向东.微生物学实验[M].北京:高等教育出版社,2007
[3]雷振河.汾酒大曲发酵过程中微生物变化的初步分析[J].酿酒科技,2011(6):65
本文经酿酒杂志授权发布,严禁任何媒体网站镜像或转载。





